
Кислоты, основания и соли
Кислоты. Окислы неметаллов, соединяясь с водой, образуют кислоты. К важнейшим из них относятся: серная - H2SO4, азотная - HN03, соляная - HCI, сернистая - H2SO3, фосфорная - H3PO4, угольная - H2CO3, сероводородная кислота - H2S.
Кислоты обнаруживаются с помощью лакмусовой бумаги, то есть промокательной бумаги, пропитанной лакмусом-экстрактом, получаемым из морских водорослей. Синяя лакмусовая бумага в кислотах изменяет свой цвет на красный.
Основания. Основания образуются путем соединения окислов металла с водой. Основания называются также гидроокисями, так как в каждом основании выступает одна или несколько гидроксильных групп - ОН.
К наиболее часто встречающимся основаниям относятся: гидроокись натрия (едкий натр) NaOH, гидроокись калия (едкий калий) КОН, гидроокись магния Mg(OH)2, гидроокись кальция Ca(OH)2, гидроокись аммония (нашатырный спирт) NH4OH.
Растворимые основания иногда называются щелочными. Как видно из примеров, общую формулу оснований можно представить в виде MeOH, где Me - означает металл, а OH - гидроксильную группу. Единственным исключением является здесь гидроокись аммония, которая вместо металла содержит группу NH4, состоящую из одного атома азота и четырех атомов водорода. Эта группа в химии носит название аммониевой группы.
Гидроокись аммония, называемая в быту нашатырным спиртом, образуется путем растворения газообразного аммиака в воде.
Основания имеют приторный, мыльный вкус, скользки на ощупь, так как разъедают надкожицу. Основания определяются при помощи красной лакмусовой бумаги, которая под их воздействием изменяет цвет на синий.
Кислоты и основания являются так называемыми электролитами. Кислота, растворенная в воде, подвергается ионизации, то есть распадается на частицы, обладающие электрическим зарядом, причем образуются положительные ионы водорода и отрицательные ионы кислотного остатка.
Соли. Если постепенно приливать к кислоте основание, то наступит момент, в котором лакмусовая бумага не будет изменять своего цвета, с красного на синий или с синего на красный. Наступила, как говорят, нейтрализация, то есть в растворе уже нет ни кислоты, ни основания, а только соль и вода. После выпаривания воды остается чистая соль.
Следовательно, соли образуются путем действия кислот на основания согласно общей формуле:
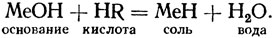
Соль есть соединение металла с кислотным остатком. Соли можно также получать, действуя кислотой на металл. При этом, кроме соли, получается (вместо воды) водород.
В СССР пользуются двумя принципами названия солей: производными от русских или латинских наименований кислот. Согласно первому принципу соли кислородных кислот образуются от названия кислоты с добавлением слова кислый (например, соли серной кислоты называются сернокислыми, сернистой кислоты - сернистокислыми, угольной кислоты-углекислыми, азотной кислоты - азотнокислыми, фосфорной кислоты - фосфорнокислыми и т. д.). Названия же солей бескислородных кислот происходят от названия элемента, образующего кислоту (например, соли соляной кислоты называются хлористыми, сероводородной кислоты - сернистыми и т. п.). Согласно второму принципу названия солей образуются от латинских названий кислотно- образующих элементов. Например, соли серной кислоты называются сульфатами, сернистой - сульфитами, угольной - карбонатами, фосфорной - фосфатами, соляной- хлоридами и др. В состав названия солей входит также название металла, например, сульфат натрия (сернокислый натрий), сульфат кальция (сернокислый кальций), сульфат меди (сернокислая медь), хлорид железа (хлористое железо) и т. д.
Соли, состоящие только из металла и кислотного остатка, не действуют на лакмусовую бумагу; это - средние соли. В кислотах, содержащих более одного атома водорода, например, серной H2SO4, сернистой - H2SO3, угольной - H2CO3 и других, металлом может быть замещен только один атом водорода. В этом случае получаются кислые соли. В названиях кислых солей слово кислый упоминается дважды или при втором способе к названию кислоты прибавляется приставка "би" (кислый сернокислый натрий-бисульфат натрия).
Кислый сернокислый натрий (бисульфат натрия) входит в состав некоторых препаратов для продолжительной завивки.
Некоторые средние соли, будучи растворенными в воде, ведут себя как основания и окрашивают лакмусовую бумагу в синий цвет. Это - соли сильных оснований и слабых кислот. Такое явление называется гидролизом. Например, сода Na2CO3 является солью сильного основания (едкого натра) и слабой угольной кислоты.
В парикмахерском деле, ввиду разрушающего действия оснований на волосы, следует ограничивать применение солей, которые в водном растворе выделяют основания в свободном состоянии.
Действие кислот и оснований на волосы. В парикмахерской практике имеют дело только с разбавленными кислотами, чаще всего с уксусной кислотой. Сильные кислоты (серная, азотная, соляная) оказывают вредное действие на волосы, разрушая их.
Растворы слабых кислот благоприятно действуют на волосы, так как приводят к лучшему прилеганию волосяных чешуек, вследствие чего волосы становятся гладкими, блестящими и легко расчесываются. Кислоты нейтрализуют основания, поэтому применяется полоскание волос кислотами для нейтрализации действия щелочей, употребляемых в профессиональной парикмахерской практике.
Основания вызывают набухание, а их концентрированные растворы в горячем состоянии приводят даже к полному растворению волос. Желая воочию в этом убедиться, можно опустить прядь волос в сосуд с крепким раствором едкого натра и подогреть его. Волосы постепенно набухают и, наконец, растворяются.
В парикмахерском деле не применяют концентрированных растворов едкого натра, однако используют многочисленные средства, в состав которых входят основания или соли сильных оснований и слабых кислот, ведущие себя как основания. К таким средствам относятся: борнокислый натрий (бура), нашатырный спирт, составы для продолжительной завивки, мыло, сода, некоторые красители для волос, а также средства для их осветления.
Под действием даже слабых растворов оснований волосяные чешуйки подвергаются частичному разрушению, вследствие чего волосы цепляются друг за друга и с трудом расчесываются. Поэтому в парикмахерском деле по мере возможности следует избегать применения щелочных препаратов, а если их применение является необходимым, то стараться нейтрализовать их действие ополаскиванием волос в растворе кислоты.
|
ПОИСК:
|
© RASTI-KOSA.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://rasti-kosa.ru/ 'Парикмахерское искусство'
При использовании материалов сайта активная ссылка обязательна:
http://rasti-kosa.ru/ 'Парикмахерское искусство'