
в) Валентность
Мы знаем, что элементы могут объединяться в соединения в различных количественных соотношениях, как, например:
1 атом железа и 1 атом кислорода - в окись железа,
2 атома водорода и 1 атом кислорода - в воду.
Это явление не случайное, оно основано на том, что каждый элемент имеет свою "валентность".
Валентность - это свойство атомов одного элемента вступать в химическое соединение с атомами другого элемента. Масштабом служит известный одновалентный элемент водород, который никогда не входит в химическое соединение с двумя или большим количеством атомов. Валентность одного элемента определяется количеством атомов водорода, входящих в химическое соединение.
Многие элементы многовалентны, например, железо двух-, трёх- и шестивалентно.
Для получения более наглядной картины сравним атомы с шариками, которые, в зависимости от их валентности, как бы протягивают друг другу руки, чтобы удержаться (см. рис. 83).
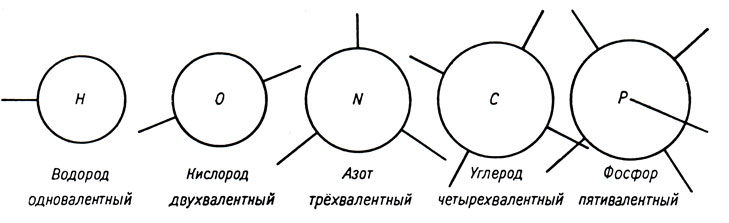
Рис. 83
Отсюда видно, что водород одновалентен, кислород двухвалентен, азот трёхвалентен, углерод четырехвалентен и фосфор пятивалентный элемент. (Сравните с таблицей элементов на стр. 91.)
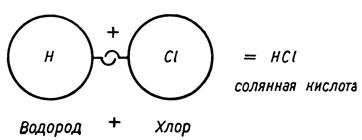
Рис. 84
В соответствии со своей валентностью атом одного элемента может входить в соединение с атомами других элементов. Водород (Н) и хлор (С1) оба являются одновалентными элементами. Поэтому один атом Н и один атом С1, как показано выше, соединяются в одну молекулу (см. рис. 84).?
Трехвалентный же азот (N) соединяется с одновалентным водородом (Н), как видно ниже на рис. 86.
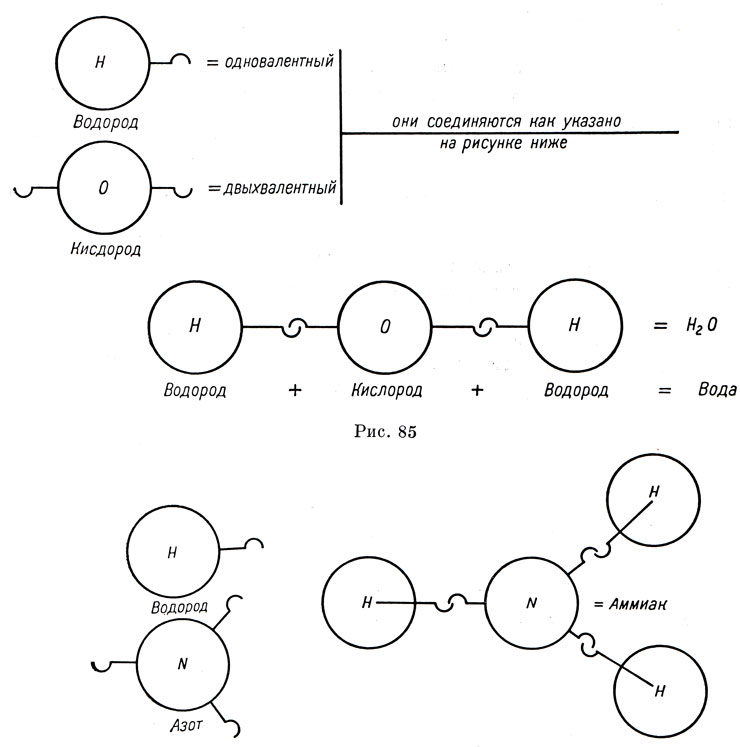
Рис. 86
|
ПОИСК:
|
© RASTI-KOSA.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://rasti-kosa.ru/ 'Парикмахерское искусство'
При использовании материалов сайта активная ссылка обязательна:
http://rasti-kosa.ru/ 'Парикмахерское искусство'